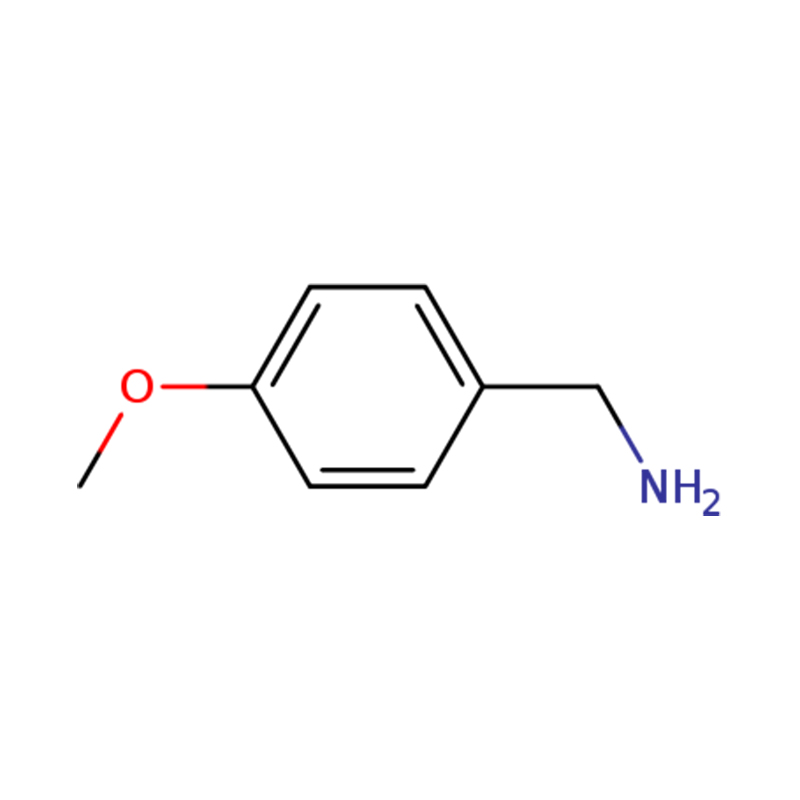
1-(4-METOKSIFENIL)METANAMINA
Detail Produk
| Nomor Kas | 2393-23-9 | Waktu Pengiriman | dalam waktu 10 hari |
| Molekuler | C8H11NO | Kapasitas Produksi | 1 Metrik Ton/Hari |
| Penampilan | Cairan bening, tidak berwarna hingga agak kuning | Kemurnian | 99% menit |
| Aplikasi | Zat antara farmasi | Penyimpanan | Suhu ruangan, gelap, tertutup rapat |
| LimitNum | 1 Kilogram | Angkutan | Udara, Laut, Ekspres. |
| Kepadatan | 1,05g/mLat25°C(lit.) | Titik didih | 236-237°C(lit.) |
| Meleleh Ponit | -10 derajat celcius | Indeks bias | n20/D1.546(lit.) |
| Titik nyala: | >230°F | Kelarutan | Sangat larut dalam air |
| Nama | p-anisilimina atau (4-metoksifenil)metanamina |
Sinonim
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETIL-ANISOL; 4-METOKSIENZILAMINA; P-Metoksibenzilamina Hidroklorida 173,64; 4-Metoksibenzilamina, 98+%; untuk Sparfloksasin; P-METOKSIENZILAMINA HIDROKLORIDA
Aplikasi
Dapat digunakan untuk sintesis zat antara farmasi. Bahan ini sedikit berbahaya bagi air. Jangan biarkan produk yang tidak diencerkan atau dalam jumlah besar bersentuhan dengan air tanah, saluran air, atau sistem pembuangan limbah. Tanpa izin pemerintah, jangan membuang bahan ke lingkungan sekitar untuk menghindari kontak dengan oksida, asam, udara, dan karbon dioksida. Jaga agar wadah tetap tertutup rapat, masukkan ke dalam ekstraktor yang rapat, dan simpan di tempat yang sejuk dan kering.
Laboratorium QC
Laboratorium QC individual terletak di lokasi yang sama, tempat dilakukannya uji kimia, uji fisika, uji mikroba, studi stabilitas, serta uji instrumen seperti IR, UV, HPLC, dan GC untuk bahan baku dan produk jadi. Seluruh area dikontrol aksesnya dan dirawat dengan baik, dilengkapi dengan instrumen analitis yang memadai untuk tujuan pengujian. Semua instrumen diberi label dengan baik dan dikalibrasi dengan tepat.
QA
QA bertanggung jawab untuk mengevaluasi dan mengkategorikan deviasi ke dalam tingkat Mayor, Umum, dan Minor. Untuk semua tingkat deviasi, investigasi untuk mengidentifikasi akar penyebab atau potensi penyebab diperlukan. Investigasi harus diselesaikan dalam 7 hari kerja. Penilaian dampak produk beserta rencana CAPA juga diperlukan setelah investigasi selesai dan akar penyebab teridentifikasi. Deviasi ditutup ketika CAPA diimplementasikan. Semua tingkat deviasi harus disetujui oleh Manajer QA. Setelah diimplementasikan, efektivitas CAPA dikonfirmasi berdasarkan rencana.